МИНЕРАЛОГИЯ
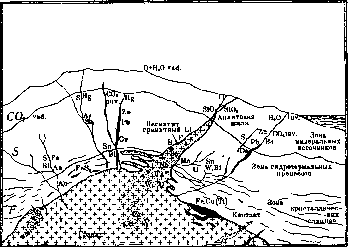
Рисунок 2. Идеальный разрез через земную кору в области гранитных магм и связанных с ними геохимических процессов.
ин-т цветных металлов в Москве. При Ком-академии в Москве имеется Институт генезиса минералов и горных пород, а при нем синтетическая лаборатория по производству опытов искусственного получения минералов. Научные минералогические вопросы широко ставятся и глубоко прорабатываются при Минералогическом музее Академии наук. В СССР существует научное минералогическое общество, основанное в 1830 г., имеющее свой орган («Записки Российского минералогического об-ва», М., с 1870). Лит.: Болдырев А., Курс описательной минералогии, вып. 1—2, Л., 1926—28; Вернадский В., Минералогия, вып. 1—2, М., 1910—1912; о н ж е, История минералов земной коры, т. I, вып. 1—2, Л., 1925—1927; о н ж е, Очерки геохимии, М.—Л., 1927; Нерудные ископаемые, изд. Академии наук СССР. т. I—V, Л., 1926—29; Федоровский Н., Курс минералогии, М.,1930; о н ж е, Минералы в промышленности и сельском хозяйстве, Л., 1927; Ферсман А., Химические элементы земли и космоса, П., 1923; N i g g 1 i P., Lehrbuch der Mineralogie, В., 1924—26. См. также лит. к ст. Кристаллы. Н. Смольягогаов. МИНЕРАЛЬНЫЕ ИСТОЧНИКИ. Источники называются минеральными, если вода их отличается от обычной воды источников или колодцев 1) более высоким содержанием растворенных веществ, или 2) содержанием редко встречающихся и терапевтически важных веществ, или же 3) более высокой t°. Принято (Deutsches Baderbuch) воду считать минеральной, если 1 л содержит более 1 г всех растворенных твердых веществ (включая гидрокарбонаты) или более 0,25 г свободного угольного ангидрида (С02); 1 мг иона лития (Li"); 10 мг иона стронция (Sr**); 5 мг иона бария (Ва**); 10 мг иона закисного или окисного железа (Fe*' или Fe"'); 5 мг иона брома (Вг'); 1 мг иона иода (J'); 2 мг иона фтора (F'); 1,3 мг иона гидро-арсената (HAs04"); 1 мг лг-мышьяковой к-ты (HAs02); 1 мг всей титруемой иодом серы (S, отвечающая H2S+HS' + S203"-f-S03"); Ъ мг м-борной к-ты (НВ02); 4 милли-эквивалента титруемой щелочности или гидрокарбонатов и карбонатов щелочей, отвечающей 340 мг NaHC03. Вода также признается минеральной, если обладает радиоактивностью более 3,5 единиц Махе или t° выше +20°. Происхождение М. и. связано с фактом циркуляции воды в земной коре. Все пласты земной коры грубо можно разделить на водопроницаемые (например песок) и водоупорные (например глина); большие количества подземных вод могут передвигаться только по первым. Выход подземной воды на поверхность может иметь место 1) при выходе водоносного пласта на поверхность на склоне горы, в овраге (а при наличии складчатости и размыва пластов—и в любых условиях рельефа), 2) при нарушении целости, или т. н. «сплошности» водоупорных пластов, покрывающих водоносный пласт; такое нарушение может быть естественным (трещины) и искусственным (буровые скважины, шахты). Сама вода минеральных ис- , точников, по Зюссу, получается двумя путями: 1) так наз. ювенильная вода выделяется в глубоких слоях земной коры или у вулканических очагов из магмы; 2) вадозные воды (см. Вадозные источники) происходят из вод поверхностных, прошедших под землей б. или м. длинный путь. Являясь весьма активным химическ. реагентом и будучи распространена на земной поверхности повсеместно, вода давно переработала те вещества, к-рьте могли вступать с нею в энергичное взаимодействие, и потому в наст, время мы наблюдаем в природе лишь сравнительно медленно идущие процессы растворения, выщелачивания, обменной адсорпции и т. п. Хим. активность. воды обусловлена в значительной мере несимметричным строением ее молекулы, полярностью молекулы; в силу этой полярности молекулы воды притягивают как друг друга (явления ассоциации), так и посторонние молекулы, а также и ионы. Этими притяжениями и обусловлена в первую очередь способность воды к растворению'и выщелачиванию горных пород. Соли й другие растворенные вещества. попадают в минеральную воду многими путями. Эксгаляции магмы, т. е. раскаленные пары, выделяющиеся из жидкой магмы, состоят не только из воды, но и еще из целого ряда веществ (H2S, C02, Н3В03, НС], щелочи); при охлаждении ббльшая их. часть растворяется в воде. Дождь и снег увлекают с собой из воздуха пыль, 02> N2, 03, S02, S03, NPI3, окислы азота, Nad': (особенно над морем) и т. д. Дождевая вода; может содержать соли далеко не в ничтожных количествах: до 950 мг NaCl, до 16 мг-NH3 в 1 л и т.д. Протекая через пласты земной коры, вода обогащается солями. Состав минеральной воды зависит от того, с какими горными породами, в какой последовательности, при каких условиях (температура и давление) и как долго находилась вода в соприкосновении. Действию воды подвержены все породы, но в разной степени. Особенно резко отличаются друг от друга воды, образовавшиеся путем взаимодействия с первичными кристаллическими горными породами, и воды,получившие свою» минерализацию в пластах пород осадочных. В первую очередь из осадочных пород выщелачиваются легко растворимые соли, захваченные ими в период осаждения солей из морской воды. Особенно энергичным растворителем является вода, обладающая кислой реакцией от присутствия угольной к-ты. или других к-т. Так, в 1 л чистой воды растворяется 0,013 з СаС03, а в воде, насыщенной С02 при 1 атм. давл.,—1,099 г СаС03. Кислая реакция может обусловливаться также гуминовыми к-тами (болотные воды) или серной к-той, получающейся при окислении сероводорода, серы, пиритов, при гидролизе сульфатов алюминия и железа. Вообще при действии на породы воды, уже содержащей. растворенные вещества (газы, соли, к-ты), происходит целый ряд реакции обмена с об- • разованием как растворимых, так и нерастворимых продуктов. Примеры реакций: СаС03 + Н20 + С02^Са(НС03)2; MgC03+H20 + C02£Mg(HC03)2; Fe0 + H20+2C02£Fe(HC03)3; CaC03+H2S04->CaS04 + H20 + C02; Fe(HC03)2+CaC03£FeC03+Ca(HC03)2; FeC03 + H,S:£FeS+H,0 + CO,; FeS2+2C02+2H2O^H2S + Fe(HC03)2 + S. Согласно с опытами и выводами новейшей теории растворов электролитов (Debye иг Нйске1)ионы, находящиеся в растворе, часто способствуют растворению трудно растворяющихся солей(CaC03, CaS04. 2Н20) и уменьшают растворимость газов. Это изменение растворимости может достигать значительной величины. Так, в 1 л чистой воды при 25° растворяется 2,08 г CaS04, а в 1 л воды, содержащей 58 г NaCl, при той же t° растворяется 6,24 г CaS04. При взаимодействии воды, содержащей Са(НС03)2 или CaS04, с породами, содержащими Na(глины), образуются NaHC03 или Na2S04; т. о. по всей вероятности объясняется генезис многих содовых и сульфатных минеральных вод. Отдельные струи вод разного состав а могут под землей встретиться и, смешавшись, дать воду нового состава. При этом может быть достигнут предел растворимости для нек-рых солей, и они выпадут из раствора. Состав полученной воды связан с количеством и составом смешавшихся вод определенной математической зависимостью. Биохим. процессы в земной коре также влияют на состав вод. Так, сульфатные воды при встрече с породами, содержащими органические вещества, часто дают сероводород и угольную к-ту. Процесс этот вызывается бактериями, к-рые живут за счет выделяемой при этом энергии (Microspira desulfuricans и др.). Простейшая схема процесса: 2C+Na2S04->Na2S+2C02; Na2S + 2C02+2H20-*2NaHC03 + H2S. В областях распространения нефтеносных и битуминозных пород часто встречаются воды, совершенно не содержащие сульфатов, обогащенные карбонатами и сульфидами. Нефтяные воды обычно относятся к хлорид-ным, часто содержат значительные количества бария (до 0,4 г в 1 л) и повышенное количество Вг' и J' сравнительно с морской водой. Биохимическими же процессами объясняется во многих случаях переход нитратов в нитриты и аммоний. Микроорганизмы принимают участие также и в образовании барежина (см.). Состав М. и. В минеральн. водах встречаются в виде «следов» почти все известные элементы, но в относительно значительных количествах — только немногие, г. о. Na*, Ca",Mg,,,C]',HC03',S04", меньше K*,H2Si03, COo,N03' и Fe'\ реже или в еще меньших количествахС03",Вг',«Г,Н8',Р',8203",800", HSiCV, HP04", HAsO/', В^/Мл-ДО-Д', Мд'\ Fe~, АГ\ Zn*\Cu",Ni",HB02, Н2ТЮ3; органич. к-ты: нафтеновые (пента- и гексаме-тиленкарбоновые), гуминовые; из газов в больших количествах выносятся минеральными водами С02, СН4, N2, в меньших H2S, COS, 02, H2, Ar, He, Ne, Кг, Хе, а также радиоактивные эманации: из коллоидов — S, Fe(OH)3, A1(0H)3, Mn(OH)a, As2S3. FeS, Н28Ю3,Н2ТЮ3,органичеекие вещества. Максимальная концентрация данного элемента и соединение, в виде которого он присутствует в минеральной воде, для большинства элементов находится в определенной зависимости от присутствия и от концентрации ряда других элементов или соединений. Так, концентрация водородных ионов определяет степень диссоциации всех слабых кислот: H2C03, H2S, H2Si03, Н2ТЮ3, H3P04, H3As04, H3B03 и т. д. Углекислота, сероводород и их ионы связаны между собой отношением [C02 + H2C03]x[HS'] = 0,3, [H2S]x[HCOa] Максимальные возможные концентрации Са (HC03)2, Mg(HC03)2, Fe(HC03)2 зависят от концентрации свободного угольного ангидрида С02. Не могут существовать одновременно в сколько-нибудь значительных количествах окислители N О 3', Fe*", Oa и восстановители—H2S. Присутствие HS', H2S или С03" практически исключает возможность присутствия в растворе ионов металлов кроме щелочных.—Коллоиды в минеральных водах часто являются продуктами метамор-физации воды уже после выхода ее на земную поверхность. Так образуются коллоидная сера, коллоидная Fe(OH)3, FeS и др.—Каталитическое действие многих минеральных вод на различные реакции (разложениеН202, окрашивание гваяковой смолы) обусловливается поверхностными свойствами коллоидных частиц, образующихся в воде. Методы хим. и физ.-хим. исследований минеральных источников являются одной из сложнейших глав физической и аналитической химии; точный и полный анализ минеральной воды может производиться только в специальной, хорошо оборудованной лаборатории. Сан.-бактериол. анализ минеральных вод производится методами, принятыми для пресных вод.—О бозначение состава минеральных вод до последнего времени было часто произвольным; приводили состав в виде окислов,ионов или комбинировали их в соли совершенно произвольно. В 1930 г. на IV Гидрологическом совещании при Управлении курортами Наркомздрава был утвержден стандарт анализа в ионной форме в виде 5 столбцов: 1) название анионов (см.), катионов (см.) и недиссоцииро-ванных соединений; 2) содержание их в граммах в1л;3)в миллимолях (миллимоль— число миллиграммов, равное молекулярному весу); 4) в милливалях (милливаль—число миллиграммов, равное эквивалентному весу; милливаль равен миллимолю, деленному на валентность иона) и 5) в вальпроцентах (процент от суммы милливалей катионов или анионов). Для характеристики и классификации минеральных вод решающим считается 5-й столбец—вальпроценты. Для наглядной характеристики минеральной воды IV Гидрологическим совещанием принята формула Курлова-Карстенса: в начале ее ставится содержание газов и активных элементов (в граммах на 1 л); затем «степень минерализации»—сумма всех ионов и нерасщепленных молекул без газов (в граммах на 1 л); дальше следует дробь: в числителе ее помещаются в порядке убывающих чисел анионы (в вальпроцентах), в знаменателе—катионы (в вальпроцентах). Те и другие вводятся в формулу только тогда, когда они содержатся в количестве, большем 25 вальпроцентов. В конце формулы ставится t° воды и дебит в гектолитрах в сутки. Пример: Александро-Ермоловский источник в Пятигорске: м С140нсо3 з8 0 ^=Г^ ^ i.jlcXJc со'г,№:* L 46^5600 • Na60Cas„ При International Society of Medical Hydrology работает специальная комиссия по стандартизации описаний М. и. Ею выра- •13 ботан стандарт, сходный с русским и отличающийся гл. обр. тем, что за единицу принят не грамм, а миллиграмм. Номенклатура и классификация минеральных вод по постановлению IV Гидрологического совещания должны основываться на названиях ионов, а не солей; как правило в название вводятся только ионы, содержащиеся в количестве не менее 25 вальпроцентов. Терапевтически активные элементы и газы вводятся в название и в формулу Курлова при концентрации их не ниже: Fe"—10 мг.,Ы'—5 мг, J'—10 мг, Вт'—25 мг, HAs04" и НР04"—I мг, H2S свободного—10 мг, С02 своб.—750 мг.—Г о р я-ч и м и называют источники с t° выше 35°; при 20°—35° их называют теплыми. Т. о. названия составляются из названий терапевтически активных веществ (в порядке убывающих концентраций в граммах), анионов (в порядке убывающих значений вальпроцентов) и катионов (в порядке убывающих значений вальпроцентов). В конце названия стоит t°, если она того заслуживает. На основе этой номенклатуры проф. В. А. Александровым в «Основах курортологии» развита новейшая классификация минеральных вод, имеющая перед всеми прежними преимущества однозначности: каждый класс имеет определенные числовые пределы, и ни одна вода не может попасть сразу в два класса. Как пример приводится анализ воды Баталинского источника. В старых клас- Баталинский источник (Кавказские мин. воды). Карстенс Температура . . . 9,6° Дебит в сутки. . . , 7,2 гл М ил- В 1 л воды Грам- М ил- Проц. мил- содержится мы мо ли вал и ли-валь Ион калия К*. . . 0,0228 0,58 0,58 0,3 » натрия Na*. . 3,7989 164,81 164,81 50,4 » кальция Са". 0,4600 11,50 23,00 7,0 » магния Mg". . 1,6877 69,28 138,56 42,3 » железа Fe". . следы — — — » алюмин. АГ" следы ' " 27= 326,95 100,0 Ион хлора СГ . . 1,3455 37,95 1 37,95 11,6 » сульфатаS04" 13,351 138,98 ! 277,96 85,0 » гидрокарбо- ната НС03'. . 0,6729 11,03 11,03 ! 3,4 1 Г= 326,94 100,0 Кремневой кисло- 0,21 Свободной СОа . . 0,1025 2,33 2 = 436,7 so4s5 M,1,1Na..M&1T •,.°, D т„ Источник сульфатный, на трневый, магнг евый сификациях, часто употребляемых еще и теперь, очень много неясностей; чтобы облегчить использование старых литературных данных, приводится сводка главнейших названий наряду с отвечающими им ионами: источники железные, железистые содержат Fe**, стальные—Fe", известковые—Са", земельные, землистые—Са", Mg", Fe", щелочноземельные—2 значения: 1) Са", Mg", 2) Са", Mg", К', Na*; щелочные—2 значения^ 1) Na*, К*, 2) воды щелочной реакции; гла-' уберовые — Na2S04; горькие, сульфатные, сернокислые—SO/'; гипсовые—CaS04; соленые, муриатич., рассольные—СГ; газовые— обычно С02, реже H2S, CH4, N2; сульфидные, сернистые, серные, сероводородные, содержащие H2S или HS' или то и другое вместе [правильнее называть сернистыми воды с S03", серными—с серой свободной (коллоидной), сероводородными—с H2S свободн.]; углекислые—С02, НС03', С03" (правильно только С02); карбонатные—СО 3^НС03'(пРа-вильно—только С03"); двууглекислые, гидрокарбонатные — НС03'; мышьяковистые, мышьяковые —As. (Обзор старых классификаций — см. Бальнеология.) — Международная комиссия по стандартизации описаний М. и. предложила в 1930 году очень простую классификацию—по одному преобладающему или активному ингредиенту, напр. хло-ридная, железная и т. п. Широкого распространения эта классификация пока не имеет. Радиоактивность минеральных вод измеряется обычно в единицах Махе (ME); колеблется от долей ME до тысяч; зависит 1) от содержания газа — эманации радия (Em); такая радиоактивность быстро исчезает, т.к. период полураспада Em равен 3,85 дня; или 2) от содержания солей самого радия или других радиоактивных металлов с большим периодом полураспада (радий— 1760 лет); такая радиоактивность может и возрастать до известных пределов, так как к ней прибавляется активность продуктов распада. — К р и о с к о п и ч е с к и е и э б у-лиоскопические исследования (понижение t° замерзания и повышение t° кипения) минеральных вод определяют общую концентрацию всех веществ, растворенных в минеральной воде, следовательно и ее осмотические свойства, или «тоничность» (tonicity). Международной комиссией по стандартизации описаний минеральных вод предложено называть «гипотоничн.ыми»воды, осмотическое давление к-рых меньше осмотического давления раствора, содержащего 9 г NaCl в 1 л, или 303 миллимоля всех ионов и молекул; «изотоничными» и «гипертонич-ными» называют воды с осмотическим давлением, равным или соответственно большим, чем у этого раствора. Изменения в составе минеральной воды могут зависеть от изменения режима источника или (чаще) от изменения условий при выходе воды на поверхность. В первом случае чаще всего изменения зависят от подтока пресной воды к основной минеральной струе; для вадозных и смешанных источников колебания состава имеют место напр. при сезонных колеэаниях количества осадков; такие изменения всегда сопровождаются изменениями дебита и обычно t°. Поэтому область питания источника должна быть защищена от возможностей загрязнения и от нарушений нормального режима вод, что является задачей горно-санитарной охраны (см.) М. и.—При выходе минеральной воды на поверхность уеловияее существования радикально меняются; это всегда сопровождается нек-рым изменением состава; часто эти изменения настолько велики, что через небольшой промежуток времени совершенно обесценивают минеральную воду. При изменении t° воды изменяются условия растворимости, и вещества, бывшие в насыщенном растворе, могут выделиться. Так, термальные источники при охлаждении часто отлагают кремнистые осадки; холодные источники, насыщенные газом, согреваясь, отдают его в виде пузырьков. Уменьшение давления тоже вызывает выделение пузырьками газов, насыщающих воду. Однако потеря газов происходит не только путем пузырьков, но и путем невидимой диффузии газа из воды в воздух. Особенно важна потеря СО2, так как благодаря этому изменяется реакция воды (повышение рН), следствием чего является переход гидрокарбонатов в карбонаты и выпадение в осадок СаС03, MgC03, Fe(OH)3. Они образуют у выхода источника отложения, называемые травертинами. С уменьшением концентрации углекислоты (соотв. повышением рН) изменяются условия сульфиднокарбонатно-го равновесия, и часть свободного H2S переходит в «связанное» состояние—в HS'.—Одновременно происходит процесс насыщения минеральной воды газами атмосферы; особенно важен здесь кислород, т. к. им обусловливается целый ряд окислительных процессов, радикально меняющих состав минеральной воды. Соединения закисного железа окисляются в соединения окиси, к-рые более подвержены гидролизу и потому обычно выпадают в осадок; то же относится и к марганцу. Свободный сероводород окисляется в зависимости от условий до серы или до серной к-ты. Сульфиды (S") и гидросульфиды (HS') при окислении дают гипосульфит (S303").H сульфат (SO/')- При этом как промежуточный продукт появляется в растворе и сульфит (S03")- Во всех этих процессах принимают большое участие микроорганизмы; их органическое вещество часто является связующим материалом для осадков S, Fe(OH)3 и др.,—так получаются студенистые массы «муффа», «барежина» и др. осадков; эти скопления вызывают закупорку труб, по к-рым минеральная вода подается к ваннам. или 'бюветам (см.). Для бальнеотехники особенно важны физич. свойства минеральной в оды. Темп, измеряется в градусах Цельсия. Теплопроводность воды (К) истинная очень мала , но практически передача тепла из ванны в тело б-ного и обратно происходит очень быстро вследствие конвекционных токов, благодаря которым слой воды, прилегающий к телу, .постоянно меняется; отдача тепла особенно ускоряется при т. наз. проточных ваннах (Strombader), при душах Шарко и т. п. Теплоемкость (С) колеблется от 1 (чистая вода) до 0,75 (крепкие рассолы), т. е. рассолы отдают телу или отнимают от него меньше тепла, чем воды малой минерализации при той же t°. Уд. в. (d) минеральных вод обычно близок к 1; повышается с увеличением количества раствор, солей и в рассолах достигает 1,3; уд. в. определяет давление воды на тело-б-ного, погруженное на известную глубину. Электропроводность Г -1 измеряется в обратных омах на 1 см3; имеет значение при гальваноминеральных ваннах; зависит от состава солей и степени их диссоциации. Материалы, употребляемые для каптажа М. и. и для проведения воды к месту пользования, подвергаются действию воды и сами влияют на ее состав. Цемент, бетон разъедаются углекислой водой и обогащают ее кальцием; сульфаты вод вызывают разрушение бетона в силу объемных изменений при образовании комплексных соединений в бетоне. Железные трубы подвержены действию углекислых, сульфидных, рассольных вод; особенно сильно 'действуют на все материалы (кроме дерева и стекла) сульфидные воды в месте их соприкосновения с воздухом; образующаяся здесь серная кислота разъедает все в очень небольшой срок; поэтому сульфидные воды необходимо проводить совершенно герметично, следя за постоянным заполнением всего сечения труб водой.—Возможность больших изменений состава минеральной воды как под землей, так и на поверхности вызывает необходимость постоянного контроля состава путем кратких анализов. Обычно вполне достаточным является ежедневное определение 1—2 ингредиентов, напр. для соленых вод—хлора; для сульфидных—H2S, щелочности (рН); для углекислых—С02 своб. и рН и т. д. Методы анализа при контроле применяются исключительно объемные или колориметрические как требующие минимум времени. Небольшие изменения в составе воды легко обнаруживаются по изменению ее электропроводности. Существуют самопишущие приборы, регистрирующие колебания электропроводности воды. Сроки и принципы наблюдения над М. и. и хим. контроля их установлены в 1925 году Главным курортным управлением. Колебания дебита или t° источника всегда указывают на некоторое изменение состава. Нагрев и охлаждение минеральной воды нужно производить, по возможности избегая соприкосновения ее с воздухом. Лучшей системой являются закрытые змеевики, охлаждаемые снаружи водой; для нагрева наиболее рациональным является метод откидных змеевиков, опускаемых в ванну и нагреваемых внутри паром. Необходимо избегать перегрева воды во избежание потери газов. При нагревании или хранении воды в баках большую услугу оказывают деревянные крышки, плавающие на поверхности воды, т. к. они сводят к минимуму поверхность соприкосновения с воздухом.— Основные условия техники розлива минеральных вод — стерильность, отсутствие аэрации. При хранении и пересылке минер. вод бутылки нужно держать в лежачем положении, чтобы пробка была всегда смочена водой: в противном случае пробка пересыхает, герметичность укупорки теряется, и с уходом газов состав воды подвергается изменению. Существенным условием устойчивости состава является низкая t°; поэтому минеральные воды обычно хранят в подва- лах и ледниках, перевозят в изотермических вагонах. Насыщение минеральной воды СО 2 значительно повышает не только вкусовые качества, но и устойчивость состава минеральной воды в бутылке; все же леч. свойства бутылочной воды не идентичны. свойствам воды у источников.—И ск.умственные минеральные воды составляются обычно из химически чистых солей по анализу естественной воды; полное тождество состава и свойств искусственной воды и естественной может быть достигнуто лишь с большим трудом; особые затруднения представляет точная имитация состава растворенных газов и свойств коллоидов. Из искусственных минеральных вод широкое распространение имеют лишь соленые ванны, ванны из морской соли, углекислые. Начинают входить в употребление искусственные сероводородные ванны. Терапевтическое применение М. и. — см. Бальнеотерапия. Зоны санит.охраны М.и.— см. Горно-санитарная охрана. Лит.: Бертенсон Л., Лечебн. воды, грязи и морские купанья в России и за границей, СПБ, 1901; Голубинин Л., Минеральные воды и лечебные грязи, М., 1911; Естественные производительные силы России, т. IV, вып. 40 — Минеральные воды, изд. КЕПС Академии наук СССР, П., 1922; К у р л о в М., Классификация сибирских целебных вод, Томск, 1928; Основы .курортологии, под ред. Г. Данишевского и М. Кончаловского, т. I—III, М., 1931; Хлопин Г., Методы санитарных исследований, т. I, Л., 1928. См. также лит. к ст. Бальнеология, Каптаж и R-урорты. С. Щукарев. Смотрите также:
Смотрите также:
- МИНКОВСКИИ Оскар (Oskar Minkowski, род. в 1858 г.); учился в Кенигсберге, Фрей-бурге, Страсбурге, где М. был учеником На-унина. Уже в возрасте 26 лет ему удалось сделать важное открытие, а именно найти ...
- МИНОР Лазарь Соломонович (р. в 1855 г.). выдающийся клиницист-невропатолог, вместе с Кожевниковым, Ротом, Корсаковым, Россолимо и др. основоположник «московской» школы невропатологов конца 19 и начала 20 вв. В 1927 г. удостоен ...
- МИНХ Георгий Николаевич (1836—1896). Окончил мед. факультет Московского ун-та в 1861 г., после чего работал в терап. клинике у проф. Захарьина и в заграничных клиниках и лабораториях, гл. обр. в пат.-анат. ...
- МИОГНАТИЯ (myognathus), разновидность двойного асимметрического уродства, когда части недоразвитого плода (паразита) помещаются где-либо в нижней части головы (близ челюсти) основного плода (аутозита), причем связь с последним представлена лишь кожно-мышечным лоскутом.
- МИОЗИТ (myositis), правильнее миит, воспаление скелетных мышц. В клин, и пат.-анат.отношениях различают несколько форм М. с самой разнообразной и присущей каждой форме этиологией (см. ниже).—Гной-ныйМ. (myositis purulenta) возникает при проникновении в ...